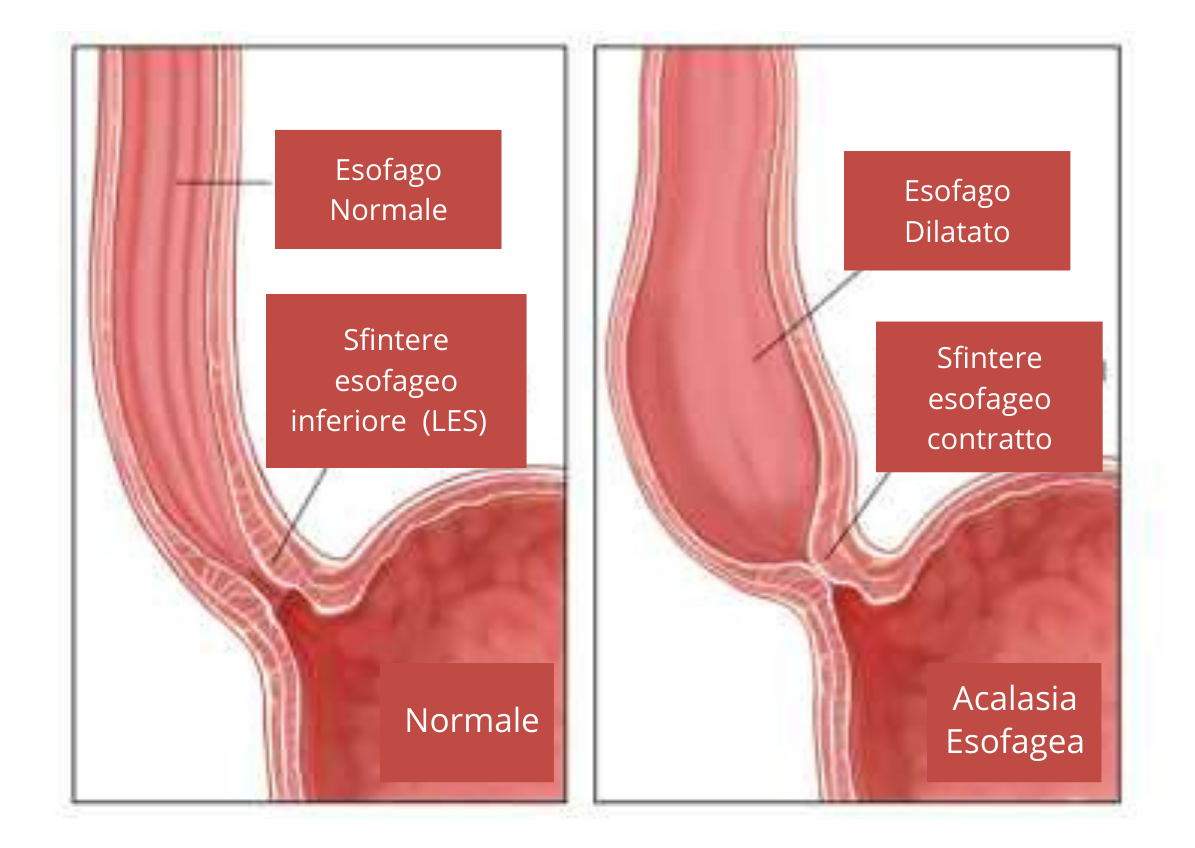
L’esofago è un tubo dotato di una tonaca muscolare longitudinale e circolare, che permette il passaggio del cibo dalla bocca allo stomaco. Esso è separato dal resto del canale alimentare da due diversi sfinteri, cioè da anelli di tessuto muscolare, che si aprono per far passare il cibo e, si chiudono, per impedirne la risalita. Lo sfintere esofageo superiore (o upper esophageal sphincter – UES) separa l’esofago dalla faringe, mentre quello inferiore (o lower esophageal sphincter – LES) lo divide dallo stomaco. Generalmente quando si deglutisce, entrambi gli sfinteri si rilassano, mentre la muscolatura esofagea si contrae. Ciò fa sì che il cibo entri nell’esofago, lo attraversi spinto dalla peristalsi, passando infine nello stomaco.
Non sempre, però, questo processo funziona correttamente. È il caso dell’acalasia esofagea, un disturbo in cui si rileva un’ostruzione del deflusso gastro-esofageo, che non deriva da anomalie strutturali, ma da un alterato rilassamento del LES, con contrazioni assenti o spastiche del corpo dell’esofago[1].
Le cause dell’acalasia
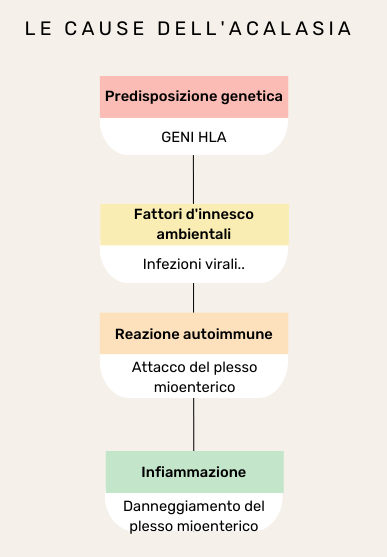
Nell’acalasia l’ostruzione del deflusso gastro-esofageo, responsabile della tipica sensazione del cibo che non scende, è causata dal mancato rilassamento del LES (si veda fig. 1), cui può associarsi un’insufficiente propulsione del cibo, dovuta ad un’alterata contrazione del corpo esofageo. L’acalasia è quindi un disturbo della motilità esofagea. Quest’ultima è controllata dal cosiddetto plesso mioenterico, anche noto come plesso di Auerbach. Esso è un sistema di fibre nervose che innerva la muscolatura esofagea, regolandone l’eccitazione e l’inibizione e, di conseguenza, la contrazione e il rilassamento. Nell’acalasia si assiste prevalentemente ad una perdita della funzione inibitoria, essenziale per il rilasciamento del LES. L’ipotesi principale è che essa sia causata da una reazione autoimmune, che attacca i neuroni mioenterici esofagei, danneggiandoli, e alterando così la motilità fisiologica dell’esofago.
Diversi studi hanno inoltre suggerito che alcune infezioni virali potrebbero contribuire allo sviluppo dell’acalasia, attivando una risposta infiammatoria persistente, in grado di danneggiare i neuroni mioenterici. Frammenti di DNA virale e anticorpi specifici per i diversi virus, infatti, sono stati trovati nel tessuto esofageo e nel sangue di pazienti acalasici [2–3]. In particolare, l’acalasia è stata associata al virus varicella-zoster, all’herpes simplex di tipo 1, al virus del morbillo e al papillomavirus umano.
Altri studi hanno però mostrato l’assenza di virus nel tessuto esofageo di soggetti acalasici[4] o la loro presenza, come nel caso dell’herpes simplex di tipo I, in soggetti senza acalasia. Ciò mostra come le infezioni virali non siano di per sé sufficienti a causare l’acalasia, suggerendo, allo stesso tempo, il ruolo concomitante di altri fattori come, ad esempio, quelli genetici. L’acalasia, infatti, è stata associata ad alcuni geni HLA, che potrebbero predisporre, chi ne è portatore, ad un’anomala attivazione immunitaria, scatenata da fattori ambientali come le infezioni (si veda fig.2).
Acalasia di tipo I, II e III
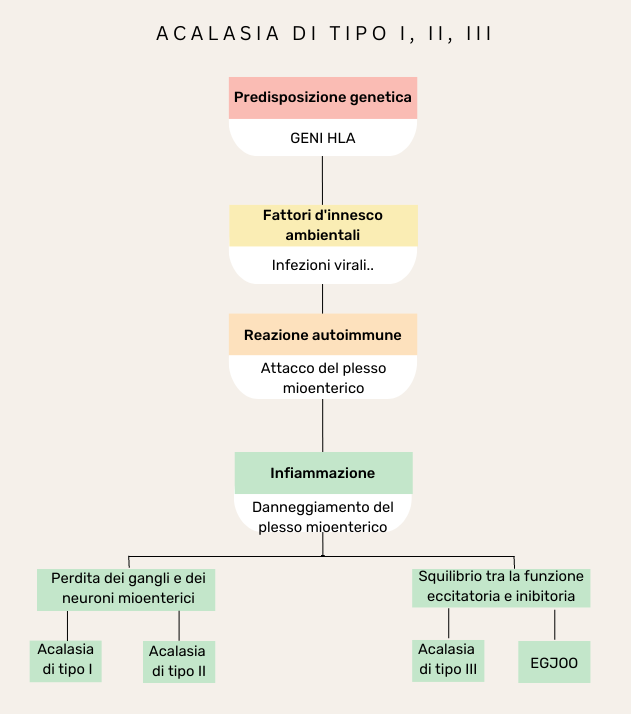
L’acalasia è un disturbo che può assumere forme diverse, che presentano caratteristiche, sintomi e risposte alle terapie specifiche. Solitamente si distinguono tre diversi sottotitpi di acalasia, accomunati dalla compromissione del rilassamento del LES e distinti, invece, sulla base della loro diversa peristalsi.
In particolare, nell’acalasia di tipo I la peristalsi è assente. La contrazione della muscolatura liscia esofagea, sia quella longitudinale (verticale) che quella trasversale (orizzontale), è compromessa. È possibile, infatti, che nell’acalasia di tipo I l’infiammazione causi la perdita completa dei gangli e dei neuroni mioenterici (vedi fig. 3). In questo caso lo svuotamento esofageo, fortemente ridotto, è strettamente dipendente dalle personali strategie di compenso sviluppate dal paziente (per es., mangiare in piedi, distendere il collo o l’intero tronco sollevando le braccia, stimolare meccanicamente l’area epigastrica con dei “colpetti”, bere molta acqua, etc.).
Nell’acalasia di tipo II la peristalsi è invece parzialmente preservata. Si registra, infatti, una forte contrazione della muscolatura longitudinale, che supporta uno svuotamento esofageo intermittente. Anche l’acalasia di tipo II è dovuta alla perdita progressiva dei neuroni mioenterici. Essi sono però compromessi in misura minore rispetto all’acalasia di tipo I.
Nell’acalasia di tipo III la peristalsi è caratterizzata invece da contrazioni del corpo esofageo premature o spastiche. Si registra, infatti, una mancata coordinazione tra la contrazione della muscolatura esofagea longitudinale e quella circolare. In questo caso il transito esofageo può essere adeguato, sebbene scarsamente omogeneo[5–6]. Nell’acalasia di tipo III si ritiene che l’infiammazione influenzi la funzionalità del plesso mioenterico, senza però causare la morte dei neuroni. In particolare, il rilascio locale di citochine può causare uno squilibrio tra la funzione eccitatoria e quella inibitoria del plesso mioenterico, causando contrazioni premature o spastiche del corpo esofageo.
Va notato, infine, che in una particolare condizione, nota come “ostruzione al deflusso della giunzione esofagogastrica” (o esophago-gastric junction outflow obstruction – EGJOO), la peristalsi del corpo esofageo è intatta, mentre si registra, similmente agli altri tipi di acalasia, un anomalo rilassamento del LES.
I sintomi dell’acalasia
I sintomi dell’acalasia, come la “sensazione del cibo che non scende” o che “si blocca alla bocca dello stomaco“, sono dovuti all’ostruzione del deflusso esofageo, che varia nelle diverse diverse fasi dell’acalasia.
Nell’acalasia precoce, ad esempio, l’ostruzione esofagea è solo parziale. L’esofago, infatti, ha ancora una buona forza propulsiva, che consente al cibo di superare, seppur non pienamente, la resistenza oppostagli dallo sfintere esofageo. I sintomi iniziali dell’acalasia si manifestano quindi in modo più sfumato e fraintendibile. In questa fase può capitare, infatti, che sintomi come il rigurgito e il dolore toracico inducano erroneamente a diagnosticare la malattia da reflusso gastroesofageo.
Nelle forme di acalasia conclamata, come quelle dei tipi I e II, i sintomi si presentano invece in modo più netto e completo. L’esofago, infatti, tende ad assumere una forma dilatata, che trattiene il cibo e ne limita lo svuotamento. In questa fase l’acalasia si manifesta attraverso i suoi sintomi cardinali, come:
- la disfagia;
- il rigurgito;
- la perdita di peso;
- il dolore toracico.
I soggetti acalasici riportano frequentemente disfagia, sia per i solidi che per i liquidi. Essi manifestano anche rigurgito di cibo e saliva non digeriti, soprattutto in posizione distesa. Può capitare, inoltre, che i pazienti siano svegliati dal rigurgito, che può essere causa di tosse e, talvolta, di un momentaneo senso di soffocamento.
L’acalasia, inoltre, può provocare perdita di peso. I soggetti acalasici, infatti, tendono a mangiare di meno a causa dei loro sintomi, oltre ad assorbire meno per l’ostruzione esofagea. L’acalasia può tuttavia presentarsi anche nelle persone obese. In questo caso è possibile che una loro minore sensibilità esofagea riduca la percezione della disfagia, consentendo ugualmente un elevato apporto calorico[7]. L’acalasia, infine, può causare dolore toracico, comune in tutti i sottotipi della malattia, ma soprattutto nel tipo III. La sua origine non è chiara, ma potrebbe essere dovuta a contrazioni spastiche della muscolatura liscia, all’ipersensibilità esofagea o a processi infiammatori dovuti al ristagno di cibo nell’esofago[8].
La pseudoacalasia
I sintomi dell’acalasia possono essere dovuti anche ad altri disturbi o condizioni, che possono mimarne le manifestazioni. In questi casi si è soliti parlare di pseudoacalasia. Tra i possibili fattori che possono causare sintomi simili a quelli dell’acalasia, come la disfagia e il rigurgito, vi sono:
- malattia da reflusso gastroesofageo;
- stenosi esofagee;
- esofagite eosinofila;
- spasmo esofageo diffuso;
- esofago ipercontrattile;
- tumori gastroesofagei;
- cancro del polmone a piccole cellule;
- cancro del rene a cellule chiare;
- malattia di Chagas;
- uso di oppioidi;
- interventi di fundoplicatio per la malattia da reflusso gastroesofageo o per l’ernia iatale.
Diagnosi dell’acalasia
La diagnosi di acalasia si basa sul riconoscimento dei suoi sintomi principali (disfagia, rigurgito, perdita di peso e dolore toracico) e sull’uso appropriato di alcuni esami diagnostici. Le indagini strumentali prevedono la gastroscopia, la manometria e l’esofagografia.
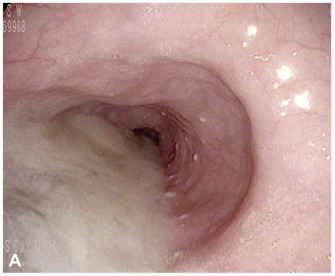
La gastroscopia viene utilizzata innanzitutto per escludere anomalie morfologiche o neoplastiche, cui ricondurre l’ostruzione del deflusso esofageo. L’endoscopia superiore può anche rilevare eventuali indizi di acalasia, come la presenza di saliva all’interno di un esofago dilatato (si veda fig. 5) o una modesta resistenza della giunzione gastroesofagea al passaggio dell’endoscopio.
La diagnosi di acalasia avviene invece attraverso la manometria esofagea ad alta risoluzione. Quest’esame , infatti, permette di valutare l’attività peristaltica dell’esofago, le sue pressioni e la capacità di rilasciamento dello sfintere esofageo inferiore. Essa consente quindi di accertare il rilassamento anormale del LES ed eventuali alterazioni della peristalsi esofagea. La manometria esofagea, inoltre, può essere utilizzata per caratterizzare i diversi tipi di acalasia esofagea
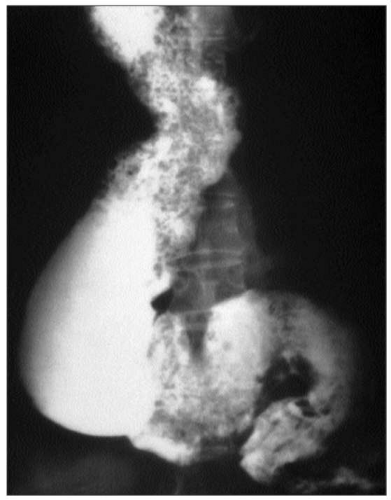
Infine l’esofagografia può essere affiancata alla manometria esofagea per approfondirne i risultati. La radiografia con pasto baritato temporalizzato, infatti, permette di studiare radiologicamente l’esofago e il transito esofago-gastrico. Essa, ad esempio, può essere utilizzata per evidenziare la dilatazione dell’esofago, la sua eventuale forma sigmoide (si veda fig. 4) o l’ostruzione del deflusso esofageo, mostrata dal passaggio rallentato e filiforme del mezzo di contrasto attraverso il LES. Quest’evidenze, inoltre, possono essere utili non solo per supportare la diagnosi di acalasia, ma anche per valutare l’eventuale risposta alla terapia.
Bibliografia
- Vaezi MF, Pandolfino JE, Yadlapati RH, Greer KB, Kavitt RT. ACG Clinical Guidelines: Diagnosis and Management of Achalasia. Am J Gastroenterol. 2020 Sep;115(9):1393-1411.
- Robertson CS, Martin BA, Atkinson M. Varicella-zoster virus DNA in the oesophageal myenteric plexus in achalasia. Gut. 1993 Mar;34(3):299-302.
- Castagliuolo I, Brun P, Costantini M, Rizzetto C, Palù G, Costantino M, Baldan N, Zaninotto G. Esophageal achalasia: is the herpes simplex virus really innocent? J Gastrointest Surg. 2004 Jan;8(1):24-30; discussion 30.
- Birgisson S, Galinski MS, Goldblum JR, Rice TW, Richter JE. Achalasia is not associated with measles or known herpes and human papilloma viruses. Dig Dis Sci. 1997 Feb;42(2):300-6.
- Mittal RK, Hong SJ, Bhargava V. Longitudinal muscle dysfunction in achalasia esophagus and its relevance. J Neurogastroenterol Motil. 2013 Apr;19(2):126-36.
- Kim TH, Patel N, Ledgerwood-Lee M, Mittal RK. Esophageal contractions in type 3 achalasia esophagus: simultaneous or peristaltic? Am J Physiol Gastrointest Liver Physiol. 2016 May 1;310(9):G689-95.
- Koppman JS, Poggi L, Szomstein S, Ukleja A, Botoman A, Rosenthal R. Esophageal motility disorders in the morbidly obese population. Surg Endosc. 2007 May;21(5):761-4.
- Kahrilas PJ, Boeckxstaens G. The spectrum of achalasia: lessons from studies of pathophysiology and high-resolution manometry. Gastroenterology. 2013 Nov;145(5):954-65.
Photo credits: Freepik


